幽门螺旋杆菌(Hp)系革兰阴性菌种,是一种能存活在人类胃黏膜组织中单级、末端顿圆且带有鞭毛、呈螺旋弯曲状的微需氧菌。它的发现使医学界对感染、炎症和癌症之间关系的有了初步了解,后来关于它的研究风靡世界各地。众多研究发现这种细菌是导致包括慢性胃炎和消化性溃疡等胃十二指肠疾病的主要病原体,甚至有导致胃腺癌发生的可能,因此国际癌症研究中心(IARC)已把Hp归入确认致癌物之列。
研究表明胃粘膜受到Hp感染后所表现出的不同临床结局除与宿主个体差异、免疫因素和环境因素有关外,还与Hp菌株的基因型有关,Hp不同基因型之间的致病性差异很大,因此感染者的临床结局也因型而异。
目前以克拉霉素等抗生素为主的三联及四联疗法是根除感染的主要方案,然而大范围频繁使用抗生素以及感染的特异性导致了其耐药率增加,对幽门螺旋杆菌进行鉴定和耐药基因突变检测,可更好地为临床提供指导。




幽门螺旋杆菌基因分型 幽门螺旋杆菌耐药基因突变 |
幽门螺旋杆菌慢性感染导致的胃黏膜炎症被称为Hp相关性胃炎,Hp通过诱发炎性活动和特异性免疫效应引发胃粘膜中性粒细胞浸润,导致胃黏膜急性活动性炎症,继而出现淋巴细胞和浆细胞浸润,导致胃粘膜慢性疾病,如持续感染,可出现萎缩、肠上皮化生及不典型增生,最终使部分宿主罹患胃腺癌。
Hp菌株能产生多种细胞毒素和毒力因子,最先被发现的是在致病性起主导作用的细胞毒素相关基因A蛋白(CagA)、空泡细胞毒素基因A蛋白(VacA),随后发现尿素酶基因(UreA)、血型组抗原结合黏附素(BabA)等对疾病的发生皆有重要作用。

CagA是目前已被证实是一种癌性蛋白,可参与胃腺癌形成,通过各种细胞激酶进行酪氨酸磷酸化,磷酸化的酪氨酸与Src同源磷酸酶2或适配蛋白GrB2相互作用,可以激活某些细胞信号传导通道,阻碍细胞间的粘附、细胞增殖、促进IL-8表达和细胞伸长。CagA也可以刺激上皮–间质转化、加速细胞增长,有促进胃黏膜上皮细胞发生变异的可能,最终导致胃腺癌形成。
VacA构成使细菌在胃上皮细胞中定殖和存活的最关键的毒素之一,VacA可能通过多种生物学机制促进胃癌的发生,首先VacA通过诱导胃上皮细胞改变可能潜在地改变胃环境以促进Hp定植和复制,有实验证实VacA还能抑制壁细胞的功能,使胃酸过少,从而促进硝酸盐的增殖而增加胃癌的风险。
BabA是一种血型抗原结合粘附素相关的毒力因子,可使幽门螺杆菌粘附于胃粘膜上皮并将毒素或其他毒力因子传递到宿主细胞中,从而促进对Hp的直接或间接损伤,BabA可粘附在胃上皮细胞,释放出过量的促炎因子,从而刺激癌变。
尿素酶通过水解尿素产生氨和CO2,从而升高胃内的PH值,克服胃内的酸性环境,有利于Hp在胃粘膜的定植。尿素酶通过多种机制调节宿主免疫反应,包括改变调理作用、增强中性粒细胞和单核细胞的趋化性,由于与II类主要组织相容性复合体(MHC)受体结合而促进细胞凋亡,增强促炎细胞因子的释放,尿素酶被认为是由于它可以刺激血管生成,而导致胃癌的进展。
目前常用的有:
1. 组织学技术(医院内镜检查常用的检查方法);
2. 血清学 IgG(一些体检机构和社区选择的常用检查方法);
3. 13C 或14C 尿素呼气试验 (UBT)等(常用于用于检测和治疗后复查)。
然而单一根据有无幽门螺旋杆菌进行根除治疗会造成以下问题:
1. 加剧抗生素耐药问题;
2. 可能增加(胃食管反流病)GERD 发病率;
3. 引起肠道菌群紊乱。
常见幽门螺旋杆菌检测比较:其他检测都是检查有无Hp感染,只有分型产品不但能检测出是否有Hp感染,还能将Hp分为高毒力株和无毒力株。
依据空泡毒素 A 基因(VacA)和细胞毒素相关基因(CagA)把幽门螺旋杆菌分为两型:I型和II型。
1. I型为高毒力菌株毒性较强,和消化性溃疡、胃癌等密切相关,应该引起医生及病人高度重视;
2. II型为无毒力菌株毒性较小,致病力弱,一般表现为轻微消化不良或者无临床症状。正常体检人群若感染为无毒株,可不必盲目选择根除治疗。
所以不是所有幽门螺旋杆菌都具有相同的致病性,I型Hp比Ⅱ型Hp有更强的致病力,幽门螺旋杆菌毒力检测分型有助于评估HP根除的必要性,为临床开展“选择性根治”提供了重要的实验诊断依据和实现“选择性精准”治疗。
因此我们要提高公众的认识度,科学对待,尽可能通过切断传播途径,减少人群和家庭的感染。如果感染了幽门螺旋杆菌,除非有抗衡因素,尽可能积极治疗并达到根除。对于感染了Hp的消化道疾病患者,应引起临床医师的足够重视,进行毒力分型检测能帮助制定根除Gp、胃镜及病理检查随访的诊疗计划,利于胃癌的预防并合理节约医疗资源。
幽门螺杆菌(Hp)是定植于胃上皮细胞的微需氧革兰氏阴性细菌,感染了世界约50%至70%的人口,有些发展中国家感染率甚至高达80%以上,是全球最普遍的病原体之一,可导致胃肠道疾病,包括消化性溃疡、胃边缘区/黏膜相关淋巴样组织淋巴瘤和胃癌。幽门螺杆菌已被世界卫生组织和国际癌症研究机构定为一类致癌物,据统计全世界超过6%的癌症和大约90%的非贲门型胃癌病例均归因于幽门螺杆菌感染。
根据世界卫生组织资料,2018年因感染引发的癌症占24.2%,其中45%归因为Hp感染,根除幽门螺杆菌将显着降低胃癌和消化性溃疡的发生率,并降低与控制这些发病率相关的成本,尤其在高流行人群中,根除幽门螺杆菌具有明显成本效益。目前幽门螺杆菌的根除方案主要包括质子泵抑制剂、胃粘膜保护剂和一种或两种抗生素,构成三联或四联疗法。用于根除幽门螺杆菌的抗生素包括克拉霉素、甲硝唑、喹诺酮类(左氧氟沙星)、阿莫西林、四环素、利福平等。
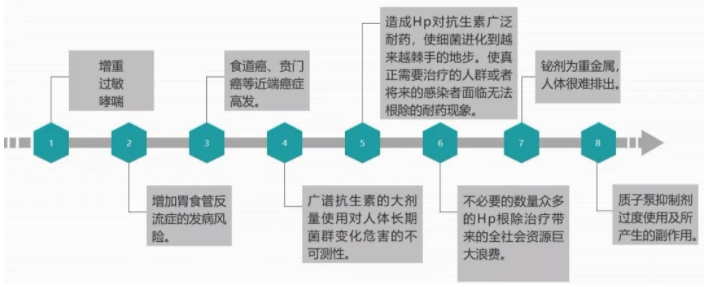
在1990年代初,根除幽门螺杆菌的比率超过80%,但是近年来,随着全球幽门螺杆菌菌株对最常用抗生素的细菌耐药性不断增加,在过去20年中,许多国家的抗生素耐药性已超过15-20%的门槛,克拉霉素、阿莫西林和甲硝唑的耐药性水平最高分别达50%、30%和95%。多药耐药性的出现显著影响幽门螺杆菌根除标准疗法的疗效,导致幽门螺杆菌的根除率在全球范围内不断下降。
为了最好地优化幽门螺杆菌感染的管理,幽门螺杆菌的治疗应基于局部和个体抗菌素耐药性模式,针对具体患者量身定制有效的抗生素治疗策略可能会大大减少治疗失败并降低抗生素耐药性。在耐药性检测方面,内窥镜引导的幽门螺杆菌培养和表型药敏试验是检测耐药性的金标准技术。但由于需要进行侵入式内窥镜检查才能从患者那里获得胃活检标本,并且幽门螺杆菌运输和培养均需要严格的条件,难度较大且很费时,至少需要10天才能完成细菌培养和抗生素敏感性测试,既费时又费钱,因此不建议在进行一线治疗之前进行完整的表型药敏试验。随着分子检测技术的不断发展和完善,分子检测在病原微生物感染诊断及治疗监测上的临床应用日益广泛,可以作为培养法药敏试验的一种有效替代方法。
目前常用的病原微生物分子检测方法主要包括实时荧光定量PCR、基因芯片技术、测序技术、焦磷酸测序技术、高通量NGS测序技术等。PCR是一种用于放大扩增特定的DNA片段的分子生物学技术,具有灵敏度高、特异性强、简便快速、对标本的纯度要求低等特点,是目前应用最为广泛的病原学检测技术。目前检测样本包括活检标本、病理切片、菌落甚至粪便,这些方法在检测23srRNA和GYRA基因突变以预测克拉霉素和左氧氟沙星等耐药性方面显示了良好的灵敏度和特异性。
用于根除Hp的常用抗生素的抗菌机制包括:
1. 阻断细菌核酸合成:喹诺酮类(左氧氟沙星)、利福平和硝基咪唑类(甲硝唑);
2. 阻断细菌核糖体合成:大环内酯类(克拉霉素)和四环素;
3. 影响细菌细胞壁合成:β-内酰胺类(阿莫西林)。
幽门螺旋杆菌导致细菌产生耐药性原因:
一. 细菌靶基因突变逃避抗生素杀菌作用:
1. 核酸合成相关基因的突变:
1)DNA回旋酶基因突变;
2)DNA依赖性RNA聚合酶基因突变;
3)氧化还原酶编码基因的突变;
2. 蛋白质翻译相关基因的突变:
1)23S rRNA编码基因V区的突变;
2)16S rRNA编码基因的突变;
3. 细胞壁合成相关基因的突变。
二. 外排系统或细胞膜的改变减少了细菌内抗生素浓度的作用:
1. 细胞膜通透性降低。
2. 生物膜形成。
3. 外排泵产生。
三. 灭活抗生素的酶的表达或影响抗生素活性的因子的分泌:
1. β-内酰胺酶的产生。
2. 毒力因子的分泌。
四. 启动耐药逃逸机制防止被抗生素杀灭:
1. 球形幽门螺杆菌。
2. 诱导自噬。
|
|
